实验十 乙酸乙酯的制备及折光率的测定(考试)
[实验目的] 1. 了解从有机酸合成酯的一般原理及方法;
2. 掌握蒸馏、分液漏斗的使用等操作方法。
[实验药品] (用量为教材中的1/2)4.75 mL无水乙醇,3 mL冰醋酸,1.25 mL浓硫酸
饱和Na2CO3溶液,2.5 mL饱和食盐水,2.5 mL饱和氯化钙,无水硫酸镁。
[仪器设备] 阿贝折光仪,加热型磁力搅拌器,标准磨口玻璃仪器
[实验原理]
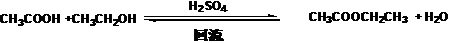
[实验步骤]
1. 粗产物的制备:于圆底烧瓶中加入4.75 mL无水乙醇和3 mL冰醋酸,再慢慢小心地加入1.25 mL浓硫酸,混匀后,加入磁子,按图安装好装置。加热回流0.5 h, 冷却后,将回流装置改装成蒸馏装置,蒸出生成的乙酸乙酯,溜出液约为反应物总体积的1/2为止。
2. 分离提纯:① 在溜出液中加入饱和Na2CO3溶液,不断振荡,直至无CO2产生,在分液漏斗中分去水层。② 将有机层用2.5 mL饱和食盐水洗涤,分去水层。③ 将有机层用2.5 mL饱和氯化钙洗涤,分去水层。④ 将有机层用水洗涤,再分去水层。⑤ 将有机层转入干燥的三角烧瓶,加入无水硫酸镁干燥。⑥ 小心倾倒出干燥后的溶液,进行蒸馏,收集73~78℃馏分。称重,计算产率。测定其折光率。
[注意事项] 1.乙醇为低沸点易燃物,操作时必须注意安全。
2.在分离提纯时,洗涤的顺序不能颠倒,否则会给分离带来麻烦(为何?)。
3.每一次洗涤时,都要注意分去水层后,再加第二个洗涤试剂(为何?)。
4.乙酸乙酯和水能形成恒沸物,用无水硫酸镁干燥时一定要干燥完全(如何判断干燥完全?)。蒸馏装置中的仪器必须事先烘干。
[思考题] P256(《基础化学实验教程》第二版),T1。


回流装置 蒸馏装置
