实验二 苯甲酸乙酯的制备
一、实验目的
1.掌握酯化反应原理及苯甲酸乙酯的制备方法。
2.学习分水器的使用,复习减压蒸馏、萃取等液体有机化合物的精制方法。
二、实验原理

三、实验药品
苯甲酸 3g ;无水乙醇7mL;浓硫酸约1.5mL;环己烷约10mL;乙醚约10mL;饱和Na2CO3溶液若干;无水CaCl2若干。
四、实验步骤
1.粗产品的制备
安装好带有分水器的回流装置(如下图所示。可选用三颈瓶或圆底烧瓶)。在反应器中加入3g苯甲酸、7mL乙醇、 5mL环己烷、1mL浓硫酸,摇匀,加沸石,在分水器中加入环己烷至支管口。缓慢加热回流约2h,至无水滴分出,分出的下层液体并记录其体积,继续蒸出多余的环己烷和乙醇,移去热源,冷却。
2.粗产品的精制
搅拌下往残液中加水约10mL,滴加饱和Na2CO3溶液中和至中性,除去硫酸和未反应完的苯甲酸。分液,有机层留存,水层用10mL乙醚萃取。合并有机层,用无水氯化钙干燥(有水滴时可用水洗,分净水层后再加干燥剂)。水浴蒸出乙醚回收。
剩余物保留,下次实验再加热蒸馏,收集210-213℃的馏分。或减压蒸馏,收集90-100℃/20mmHg的馏分。

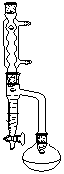
分水回流装置图
五、注意事项
1. 回流要慢一些,一开始回流快了容易形成液泛。
2. 水-乙醇-环己烷三元共沸物的共沸点为62.6℃,其中含水4.8%、乙醇19.7%、环己烷75.5%。根据理论计算,生成的水(包括95%的乙醇的含水量)约为1g。
3. 多余的环己烷和乙醇由分水器放出。
4. 加碳酸钠时要慢,否则,过于剧烈会产生大量气泡而使液体溢出。
5. 若初产物中含有絮状物难以分层,可直接用适量乙醚萃取。
6. 本实验也可用微波炉进行:装置同上,反应器置于微波炉中,650W反应约6-7分钟,直到无水滴分出。其它步骤同上。
六、思考题(蓝色为必做题,黑色题请教师根据同学情况安排,以下同)
1.本实验采用何种措施提高酯的产率?
2.浓硫酸的作用是什么?常用酯化反应的催化剂有哪些?
3.在萃取和分液时,两相之间有时出现絮状物或乳浊液,难以分层,如何解决?
